Fluorescens er en type luminescens som opphører med en gang bestrålingen av stoffet stanser.
Luminescens er lysstråling som opptrer ved lave temperaturer.
Molekyler belyses med lys som eksiterer elektronene. Deler av energien frigis som vibrasjonsenergi, mens resten avgis litt forsinket som fotoner. Dette kalles fluorescens. Fluorescensmolekylene opptar energi i form av lys ved bestemt bølgelengde (eksitasjon) og avgir energi ved en annen bølgelengde (emisjon = fluorescenslyset). Eksitasjonslyset har kortere bølgelengde enn emisjonslyset og har dermed høyest energi.
Figur 1: Eksempel på et ekistasjon-emisjon spekter for hydrogen (7)
I en fluorescens analyse vil en prøve belyses med et eksitasjonslys, og den vil avgi et emisjonslys som har en høyere bølgelengde enn eksitasjonslyset:
Figur 2: Skisse av komponentene i et spektroflurometer (4).
Når en lyskilde bestråler prøven med fotoner blir lysets energi absorbert,prøven går fra hvilefase S0 til den eksiterte fasen S'1, som er fasen med mest energi. Dette kalles eksitasjon. Det som skjer er at elektronene i en elektronskall blir flyttet opp til neste elektronskall.
På grunn av vibrasjoner, konformasjonsendringer og spredning av energien vil den høye ladningen gå tapt og prøven stabiliseres til fasen S1. En kort stund etterpå vil prøven avgi mesteparten av energien emitert bort som lys med høyere bølgelengde enn eksitasjonslyset og gå tilbake til hvilefasen S0.
Figur 3: Jablonski diagram som viser eksitasjon og emisjon av elektroner (5).
Begrensninger i analyser med fluorecensspektrometer vil være at ved høye konsentrasjoner (Abs høyere enn 0,05) vil det oppstå en indre filtereffekt. Det som skjer da er at store mengder lys blir absorbert av prøven slik at det er for lite lys til å danne flurescens lengre inn i kuvetten og at emittert lys blir absorbert i blandingen. En annen effekt som kan stoppe fluorescensreaksjonen er quenching. Det vil si at det er tilværelse av stoffer som hindrer fluorescens.
Energiforskjellen, ∆E, mellom eksitasjons- og emisjonsenergi kalles Stokes shift og er ofte konstant for et stoff.
Både UV-lys og synlig lys kan gi fluorescens, men fluorescenslyset er alltid synlig lys (380-780nm).
Det finnes ulike kriterier for at stoffer skal kunne fluoriscere. Elektronene bør ikke befinne seg i et orbital som inngår i en enkeltbinding, de må kunne eksitere ved liten energitilførsel og stoffet må ha en høy absorbtivitet for den aktuelle bølgelengden. Stoffer som vil fluoriscere er de fleste molekyler med dobbeltbindinger, sammenkoblete aromater og de fleste stabile plane ringstrukturer, for eksempel Quinolin. Noen stoffer kan i utgangspunktet ikke fluoriscere, men blir mer stabile ved kompleksbindelse med et metall og kan dermed fluoriscere, for eksempel 8-hydroxyquinolin.
| Figur 4: En samling forskjellige fluoriscerende mineraler under UVA, UVB og UVC- lys (1). |
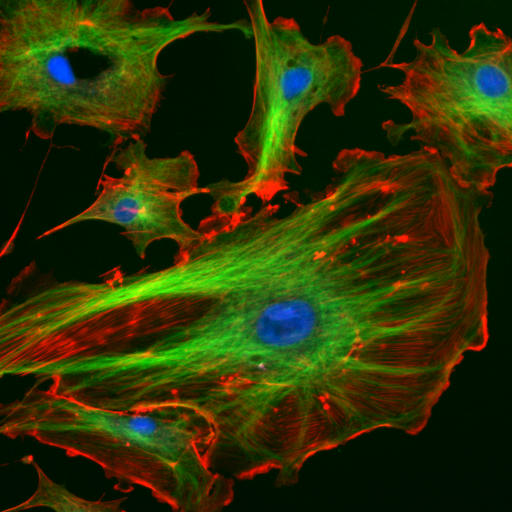
| Figur 5: Fluoriscerende endotelceller under mikroskopet. Kjernen er markert blå, mikrotubuli grønn og aktinfilamentene rød (3). |
Referanser
- http://en.wikipedia.org/wiki/Fluorescense
- (1) & (2) This file is licensed under the Creative Commons Attribution ShareAlike 2.5 License. In short: you are free to share and make derivative works of the file under the conditions that you appropriately attribute it, and that you distribute it only under a license identical to this one. Official license
- (4) http://www.thefullwiki.org/Spectrofluorometer
- (5) http://icecube.berkeley.edu/~bramall/work/astrobiology/fluorescence.htm
- (6) http://www.snl.no/fluorescens - Trygve Holtebekk
- (7) http://micro.magnet.fsu.edu/primer/lightandcolor/fluoroexcitation.html